Glückauf! Stipendium
– Für den Nachwuchs in der Krebsforschung
Die Begeisterung junger Medizinerinnen und Mediziner für die Krebsforschung ist ein zentrales Anliegen des Fördervereins Innere Klinik – Tumorforschung – Essen. Das studienbegleitende Promovieren und die Forschungsprojekte auf allen Gebieten der Krebsmedizin werden immer komplexer und anspruchsvoller. Promotionsprojekte, die zu einem bedeutsamen Erkenntnisgewinn führen sollen, können von den jungen Studierenden dann in erfolgversprechender Weise durchgeführt werden, wenn diese sich für eine gewisse Zeit voll auf ihr Forschungsprojekt konzentrieren. Ein spannendes Promotionsprojekt ist für viele Nachwuchsmedizinerinnen und -mediziner der Einstieg in die Universitätsmedizin, da durch die Erfahrung des Arbeitens in einem motivierten und professionellen Forschungsteam meist ein weiterführendes Interesse geweckt wird.
Ermöglicht durch die großzügige Zuwendung der Familie eines Patienten unserer Klinik stiftet der Förderverein Innere Klinik – Tumorforschung – Essen e.V.


Spendenkonten Förderverein Innere Klinik – Tumorforschung – gemeinnütziger Verein e.V.
| Volksbank Ruhr-Mitte IBAN DE10422600010000101100 BIC GENODEM1GBU |
| Sparkasse Essen IBAN DE43360501050004904991 BIC SPESDE3EXXX |
Jedes Jahr zwei Glückauf! Doktorandenstipendien
Gefördert werden pro Kalenderjahr jeweils zwei medizinische Doktorandinnen oder Doktoranden einer der Arbeitsgruppen der Inneren Klinik (Tumorforschung), die für die Durchführung ihres Promotionsprojekts ein Freisemester investieren. Die Geförderten erhalten für bis zu 6 Monate ein Stipendium von bis zu 500 EUR pro Monat, um ihnen den notwendigen Freiraum für ihre Forschung zu ermöglichen.
Bewerbungen mit einseitiger Projektskizze, Nachweis der Annahme des Promotionsthemas durch die Medizinische Fakultät und Unterstützungsschreiben des Promotionsbetreuers können jederzeit in der Geschäftsstelle des Fördervereins zu Händen von Herrn Florian Teusner eingereicht werden.
Wir freuen uns auf interessante Projektvorschläge.
Der Vorstand
Förderverein Innere Klinik – Tumorforschung – Essen e. V.
D. Blanck (1. Vorsitzender), Prof. Dr. M. Schuler (2. Vorsitzender), S. Aleff (Schatzmeisterin)
Stipendiaten
Mittlerweile konnten bereits drei glückliche Stipendiaten in ihrem Promotionsvorhaben durch das von den Mitgliedern des Fördervereins im Jahr 2020 gestiftete „Glückauf!“-Stipendium gefördert werden. Die jungen Forscher sind sehr dankbar, durch die Hilfe des Fördervereins die Möglichkeit erhalten zu haben, sich umfassend ihrer wichtigen wissenschaftlichen Arbeit widmen zu können.
Förderverein Innere Klinik
Tumorforschung – Essen e.V.
Geschäftsstelle
Innere Klinik (Tumorforschung)
Universitätsklinikum Essen
Hufelandstraße 55
45147 Essen
Im Rahmen seines medizinischen Promotionsprojektes beschäftigt sich Herr Nils Dieckmann mit der Erforschung von genomischen Mustern bei Weichgewebssarkomen in der Arbeitsgruppe von Oberarzt Prof. Dr. Sebastian Bauer.
Um sich vollständig auf das Projekt fokussieren zu können, hat Herr Dieckmann sein Studium für einige Monate pausiert; während dieses Zeitraums wird er von dem Förderverein der Inneren Klinik (Tumorforschung) als erster Stipendiat des neu eingerichteten „Glückauf!“-Stipendiums gefördert.
Ziel seines Forschungsprojektes ist die Erforschung von Markern in der Erbsubstanz (DNA), die das Ansprechen auf eine Chemotherapie vorhersagen könnten.
Bisher erfolgt die Behandlung mit Chemotherapie ausschließlich auf klinischen Erfahrungswerten. Molekulare Marker, die den Erfolg oder auch Misserfolg einer Therapie vorhersagen könnten, sind bislang nicht identifiziert. Kürzlich wurden durch eine Gruppe von Wissenschaftlern an der UCL-Universität in London erstmalig bei einer Subgruppe von Sarkomen Erbsubstanz-Muster beschrieben, die möglicherweise den Erfolg von Therapien erklären könnten. Eine Überprüfung dieser Muster mit dem Therapieansprechen von Zelllinien oder auch einer größeren Gruppe von Patienten steht jedoch noch aus.
Kooperationspartner dieses Projektes sind Herr Prof. Schildhaus, Sarkom-Pathologe des Universitätsklinikums Essen und Herr Prof. Pillay – ebenfalls Sarkom-Pathologe – vom University College London.
Herr Dieckmann plant, seine wissenschaftlichen Arbeiten auch nach Ablauf des Freisemesters in der Arbeitsgruppe fortzuführen und hofft, dass er zum Abschluss des Projektes einen Marker finden wird, der auch für die Therapie von Patienten relevant werden wird.
Doktorand Marc Biller studiert Humanmedizin an der Universität Duisburg-Essen. Seit Oktober dieses Jahres befindet auch er sich in einem Freisemester, um als Mitglied der Arbeitsgruppe von Prof. Barbara Grüner in unserem Hause zu dem Thema „In vitro and in vivo characterization of top TKI compounds on PDAC metastatic ability” zu forschen.
In Zusammenarbeit mit einer weiteren Arbeitsgruppe aus München validiert er in seinem Forschungsprojekt therapeutisch vielversprechende molekulare Wirkstoffe hinsichtlich ihrer Wirkung auf die Metastasierung des duktalen Adenokarzinom der Pankreas.
Zu Beginn wird anhand von in vitro Versuchen die Pharmakologie der verschiedenen Wirkstoffe genauer eruiert, zum Beispiel mithilfe von sogenannten Invasions- oder Migrationsassays. Damit können jedoch nur einzelne Schritte des Metastasierungprozesses isoliert betrachtet werden.
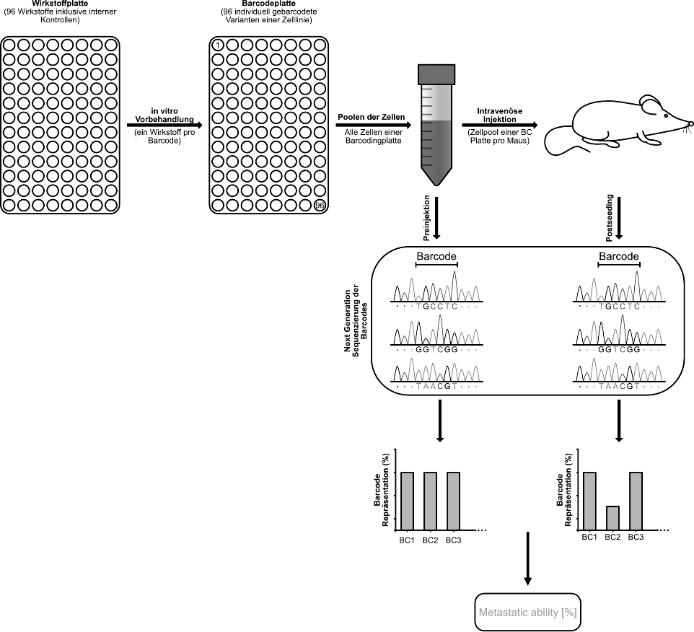
Da die Metastasierung ein komplexer und mehrstufiger Prozess ist, spiegeln diese Experimente die biologische Realität oft nicht adäquat wider und Wirkstoffe, die in der Zellkultur Wirkung zeigen, versagen oft später in präklinischen und klinischen Tests. Um diese Einschränkungen zu überwinden hat meine Arbeitsgruppe eine in vivo Multiplex-Screening-Plattform für kleine Moleküle entwickelt, die molekulare DNA-Barcodes in Kombination mit Next Generation Sequenzierung (NGS) verwendet (s. Abbildung).
Beim molekularen Barcoding wird eine DNA-Barcode-Sequenz (oder kurz Barcode) verwendet, die stabil in das Genom von Zellen eingebaut wird, um einzelne Zellen mit einer eindeutigen und vererbbaren Signatur zu kennzeichnen. Als Next Generation Sequenzierung werden neuartige Technologien zur Sequenzierung von DNA und RNA bezeichnet, die wesentlich schneller, kostengünstiger und quantitativer als konventionelle Methoden sind.
In unserer Screening-Plattform werden NGS genutzt, um die unterschiedlichen Zell-Barcodes wieder quantitativ auszulesen. Damit ist es möglich, das Schicksal individuell gebarcodeter Krebszellen innerhalb eines Zellpools im Organismus nachzuverfolgen. Für unsere Barcoding-Plattform haben wir circa 100 verschiedene Tumorzellvarianten mit jeweils individuellen einzigartigen Barcodes von metastasierenden PDAC Zellen erzeugt. Jede dieser Varianten kann dann mit einer individuellen zu testenden chemischen Verbindung in vitro vorbehandelt, mit allen anderen (ebenfalls individuell behandelten) Zellvarianten zusammen gepoolt und dann intravenös in eine Empfängermaus injiziert werden. Nach dem sog. „metastatic seeding“ werden die mit einem Barcode versehenen Tumorzellen, die diesen Prozess erfolgreich durchlaufen konnten, aus der Lungen der transplantierten Mäuse wieder isoliert.
Schließlich wird die Repräsentation der einzelnen Barcodes (und damit der verschieden behandelten Tumorzellpopulationen) durch Sequenzierung der Proben vor und nach der initialen Metastasierung im Organismus bestimmt. Dies ermöglicht die parallele Quantifizierung der Wirkung jeder Vorbehandlung auf das metastatische Potential. Tumorzellen, die mit einem potenziellen Inhibitor der Metastasierung behandelt wurden, können sich dadurch nicht in den Lungen der transplantierten Mäuse ansiedeln. Dies wird durch eine reduzierte Repräsentation des DNA-Barcodes, mit dem diese Zellen markiert waren, in den in vivo Proben (also nach dem metastatic seeding) angezeigt. Durch die Barcoding Methode können so knapp 100 chemische Moleküle und zugehörige Kontrollen in einer einzelnen Maus gleichzeitig getestet werden.
Im Rahmen seiner medizinischen Doktorarbeit forscht Herr Viyan Arab seit April 2025 in der Arbeitsgruppe von Prof. Barbara Grüner an der häufigsten Form des Bauchspeicheldrüsenkrebses: dem duktalen Adenokarzinom des Pankreas.
In über 90 % der Fälle liegt diesem Tumor eine Mutation im KRAS-Gen zugrunde. Dieses Gen reguliert normalerweise Zellwachstum und -teilung. Mutationen führen jedoch zu einem dauerhaft aktiven Signalprotein, das unkontrollierte Zellteilung auslöst. Neu entwickelte KRAS-Inhibitoren greifen gezielt dieses Protein an und zeigen in ersten Studien vielversprechende Ergebnisse. Allerdings sprechen viele Patientinnen und Patienten gar nicht oder nur vorübergehend darauf an – es kommt zu Resistenzen.
Ziel des Forschungsvorhabens ist es, die Mechanismen dieser Resistenzen aufzuklären. Hierzu testet Herr Arab verschiedene Inhibitoren in vitro an speziell gezüchteten Mauszelllinien mit der typischen KRAS-G12D-Mutation sowie weiteren genetischen Veränderungen, die auch im menschlichen Bauchspeicheldrüsenkrebs häufig vorkommen. So untersucht er, wie zusätzliche Mutationen das Ansprechen auf die Inhibitoren beeinflussen.
Mit Zellviabilitätsassays ermittelt er, in welchem Maße die Medikamente das Zellwachstum hemmen und in welchen Konzentrationen sie wirksam sind. Ergänzend prüft er auf Proteinebene, ob die Inhibitoren tatsächlich die KRAS-Signalkaskade beeinflussen.
In ersten Ergebnissen konnte Herr Arab bereits einen sehr interessanten Signalweg identifizieren, der eigenständig Ziel klinischer Studien ist und in vitro einen Effekt auf das Therapieansprechen hat. In Kombination mit KRAS-Inhibitoren wurde er bislang jedoch wenig untersucht. Aktuell erforscht er, wie sich die Veränderung dieses Signalwegs auf die Wirksamkeit der KRAS-Inhibitoren auswirkt.
Langfristig soll diese Forschung zu einem besseren Verständnis der Resistenzmechanismen führen und die Wirksamkeit neuer Therapien steigern, um die Überlebenschancen der Betroffenen zu verbessern. Für sein Projekt hat Herr Arab ein Freisemester genommen und wird dabei durch das Glückauf!-Stipendium des Fördervereins der Inneren Klinik – Tumorforschung – Essen e.V. unterstützt. Dies ermöglicht ihm, sich vollständig auf seine Forschung zu konzentrieren.

Viyan Arab, cand. med.
AG Zellplastizität und Metastasierung

Leon Rudel, cand. med.
AG Molekulare Onkologie
Im Rahmen seines Promotionsprojektes, das durch ein „Glück Auf!“-Stipendium über den Förderverein ermöglicht wird, beschäftigt sich Herr Leon Rudel in unserer Arbeitsgruppe „Molekulare Onkologie“ damit, wie bestimmte molekulare Faktoren das Ansprechen auf neue Therapien bei Lungenkrebs beeinflussen. Auch heute noch zählt diese Krebsform zu den häufigsten Todesursachen in Deutschland. Ein vielversprechender Therapieansatz ist es, zielgerichtete Antikörper zu geben, die eine Abwehrreaktion des Immunsystems auf den Tumor ermöglichen.
Allerdings stehen Mitglieder einer bestimmten Genfamilie (sog. MYC-Onkogene) im Verdacht, den Erfolg dieser zielgerichteten Therapie bei nicht-kleinzelligem Lungenkrebs (NSCLC) zu behindern. Deshalb wird Herr Rudel im Rahmen seiner Forschungsarbeit mit dem Titel „Die Rolle des onkogenen MYC bei der Modulation der T-Zell-Sensitivität von Lungenkrebs im Rahmen der Immun-Checkpoint Blockade“ untersuchen, welchen Einfluss es auf das Immunsystem hat, wenn der Tumor viel oder wenig MYC bildet. Dazu arbeitet er mit Lungenkrebszellen in denen er mit molekularbiologischen Tricks MYC-Gene an- und ausschalten kann. Mit darauf aufbauenden Experimenten kann so deren Einfluss auf das Immunsystem näher untersucht werden.
Wir erwarten hiervon ein besseres Verständnis darüber, warum zielgerichtete Antikörpertherapien bei manchen Patienten mit NSCLC phänomenal wirken und bei anderen nur wenig helfen, um zukünftig noch präziser die besten Therapien anwenden zu können.
Seit Oktober 2021 beschäftigt sich Herr Lennart Schardt in der Arbeitsgruppe von Oberarzt Prof. Dr. Sebastian Bauer mit der Erforschung von DNA-Reparaturgenen in Gastrointestinalen Stromatumoren (GIST).
Um sich vollumfänglich auf das Forschungsvorhaben zu konzentrieren, hat Herr Schardt ein Freisemester genommen, in dem er durch das Glückauf-Stipendium vom Förderverein der Inneren Klinik gefördert wird.
Die VOYAGER-Studie, bei der Prof. Bauer globaler Studienleiter war, konnte durch Blutanalysen einen einzigartigen Datensatz von 476 Patienten erheben. Innerhalb dieser Studie wurden zahlreiche Mutationen in DNA-Reparaturgenen gefunden. Leider weiß man recht wenig über die Relevanz dieser Mutationen. Im Rahmen seiner medizinischen Doktorarbeit versucht Herr Schardt zu validieren, inwiefern diese DNA-Reparaturgene als prädiktive Marker, das Ansprechen auf eine Therapie mit Tyrosinkinaseinhibitoren in GIST vorhersagen können.
GIST sind die häufigsten Sarkome des Menschen. Eine Therapie mit Tyrosinkinaseinhibitoren ist häufig effektiv, dennoch entwickeln ca. 50% der Patienten eine Resistenz gegen diese Inhibitoren. DNA-Reparturgene könnten bei der Entwicklung dieser Resistenzmechanismen eine bisher unentdeckte Rolle spielen.
Herr Schardt hat im vergangenen Jahr wichtige Zellexperimente durchgeführt, die er auch noch nach seinem Freisemester weiter fortführt. Er erhofft sich in Zukunft besser zu verstehen, welche Rolle DNA-Reparaturgene in GIST spielen.

Lennart Schardt
AG Molekulare Tumorpathologie